Vacina produzida pela Fiocruz passa a ter registro definitivo e medicamento será o primeiro com indicação para tratamento da covid-19
Publicidade
Conheça o maior e mais importante evento do setor de saúde do Brasil.
A Agência Nacional de Vigilância Sanitária (Anvisa) certificou o medicamento remdesivir para o tratamento de covid-19. A agência sanitária também concedeu o registro definitivo para a fabricação da vacina Oxford/AstraZeneca, produzida pela Fundação Oswaldo Cruz (Fiocruz) no Brasil.
O remdesivir é o primeiro e único remédio com indicação em bula para combater o coronavírus. O antiviral já tinha sido autorizado por agências sanitárias de mais 50 países, entre elas a Food and Drug Administration (FDA) dos Estados Unidos e a Agência Europeia de Medicamentos (EMA). Em novembro do ano passado, a Organização Mundial da Saúde (OMS) não recomendou o uso do medicamento por falta de estudos robustos.
A vacina desenvolvida pela AstraZeneca é o segundo imunizante a obter o registro definitivo no Brasil. No entanto, diferentemente da primeira autorização concedida para a Pfizer, que pode vender doses ao setor privado, a vacina produzida pela Fiocruz só poderá ser distribuída pelo Ministério da Saúde e por organismos multilaterais.

O remdesivir, produzido pela empresa Gilead Sciences, foi criado originalmente para tratar ebola, porém, como tem atuação antiviral, impedindo que o Sars-CoV-2 se conecte às células, passou a ser usado experimentalmente contra doenças respiratórias.
A autorização da Anvisa recomenda o uso do medicamento da seguinte forma:
Durante o anúncio da aprovação, o especialista em regulação e vigilância sanitária da Anvisa Raphael Sanches afirmou que aspectos de segurança e qualidade foram analisados pela agência a partir dos estudos clínicos realizados pela fabricante, além de monitoramento de níveis de impureza do medicamento, risco de toxicidade, estabilidade do medicamento, prazo de validade, entre outros.
Os estudos apontaram que os pacientes que tomaram o remdesivir se recuperaram em 10 dias, enquanto os que não receberam a medicação tiveram melhora em 15 dias. Nos estudos, não houve registro de óbitos, mas foram observados efeitos adversos, como toxicidade no rim.
Apesar da aprovação, faltam complementações de análise pendentes para gerar um histórico do produto. “Resta ainda a complementação na justificativa das especificações, porque isso requer esclarecimentos que não são críticos, mas que precisam ser realizados”, explicou Sanches.
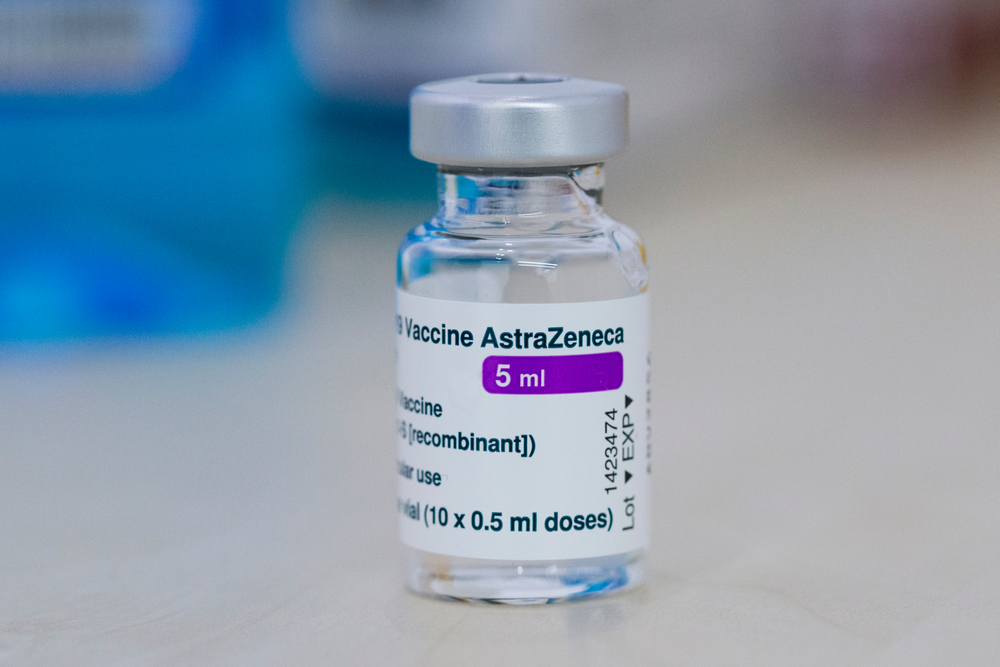
Os registros emergenciais dos imunizantes da AstraZeneca, fabricados pelo Instituto Serum da Índia, assim como da CoronaVac, produzida pelo Instituto Butantan, permitem a aplicação da vacina pelo programa de imunização contra a covid-19. Agora, a Fiocruz recebeu a autorização definitiva para a entrega de doses totalmente fabricadas no Brasil.
O pedido de registro definitivo é diferente da autorização de uso emergencial. Enquanto a imunização emergencial é restrita a grupos específicos e cada lote deve ser liberado individualmente, a permissão definitiva dispensa análises adicionais e possibilita a aplicação em qualquer indivíduo e a comercialização do produto.
O registro definitivo da Anvisa segue as regras de armazenamento e uso da vacina autorizada de forma emergencial. A aplicação deve ser realizada em duas doses, com intervalo de 8 a 12 semanas em pessoas acima de 18 anos de idade. O imunizante tem validade de seis meses quando armazenado entre 2 °C e 8 °C, 48 horas em geladeira comum e de 6 horas fora da geladeira.
Fonte: TV Brasil, Agência Brasil.